我们的服务

医疗器械经营许可证(备案)服务
1. 医疗器械经营许可(备案)要求
(1)根据《医疗器械监督管理条例》(国务院令第650号)要求:
第二十九条 从事医疗器械经营活动,应当有与经营规模和经营范围相适应的经营场所和贮存条件,以及与经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。
第三十条 从事第二类医疗器械经营的,由经营企业向所在地设区的市级人民政府食品药品监督管理部门备案并提交其符合本条例第二十九条规定条件的证明资料。
第三十一条 从事第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府食品药品监督管理部门申请经营许可并提交其符合本条例第二十九条规定条件的证明资料。
(2)根据《医疗器械经营监督管理办法》(国家食品药品监督管理总局令第8号)要求第二条 在中华人民共和国境内从事医疗器械经营活动及其监督管理,应当遵守本办法,申请医疗器械经营许可证或备案凭证。
2. 医疗器械经营许可(备案)资料要求
| 许可/备案流程 | 资料要求及确认工作 | 客户 配合工作内容 | |
营业执照 组织代码证 | 1.全体投资人签署的《企业名称预先核准申请书》 2. 全体投资人签署的《指定代表或者共同委托代理人的证明》及指定代表或者共同委托代理人的身份证件复印件 3.取得医疗器械营业执照和组织机构代码证 | 全体投资人签署对应文件 | |
| 确定经营许可范围 | 确认需要办理经营许可的品种(部分II类医疗器械或体外诊断试剂不需要办理经营许可) | 提供拟经营的医疗器械品种 | |
| 申请前准备工作 | 人员及培训 | 企业负责人、质量负责人、专业技术人员(大专或中级职称)、验配人员(如需要)相关资质证明 | 提供相关人员简历、身份证书、安排相关人员培训及体检 |
| 场地及设施 | 经营场地证明文件 | 提供经营场所证明文件 | |
| 经营产品 | 医疗器械注册证书、生产或经营资格证明,购销凭证及协议 | 提供相应证明文件 | |
| 经营管理制度及记录 | 建立产品采购索证制度、进货验收制度、仓库保管制度、出库复核制度、效期产品管理制度、不合格品的确认和处理制度、购销记录档案制度、产品售后服务制度,质量问题投诉和查询制度、产品质量跟踪和不良事件报告等制度,拟经营植入(介入)类医疗器械的还应有售前、售后服务规范,拟经营有特殊验配要求医疗器械的还应有验配管理规范 | 提供原有管理制度档 | |
| 销售及售后服务 | 建立销售记录保存2年以上,建立售后服务、培训及召回机制 | 提供原有文档 | |
| 自查自评 | 依据相关标准,提供自查表 | 配合自查自评 | |
| 申报资料制作 | 申请材料编制 申请材料签章 | 签章确认 | |
| 准备电子及纸质申请材料 | 在线申请,并打印医疗器械经营企业许可证申请表(如需要),及其它申请材料 | 核对及签章 | |
| 经营许可受理,资料审查及现场检查 | 配合资料补正及现场核查 | 配合现场核查 | |
| 经营许可公示及发证 | 获得经营许可证书或经营备案凭证 | 获得经营许可证书 | |
3. 服务流程
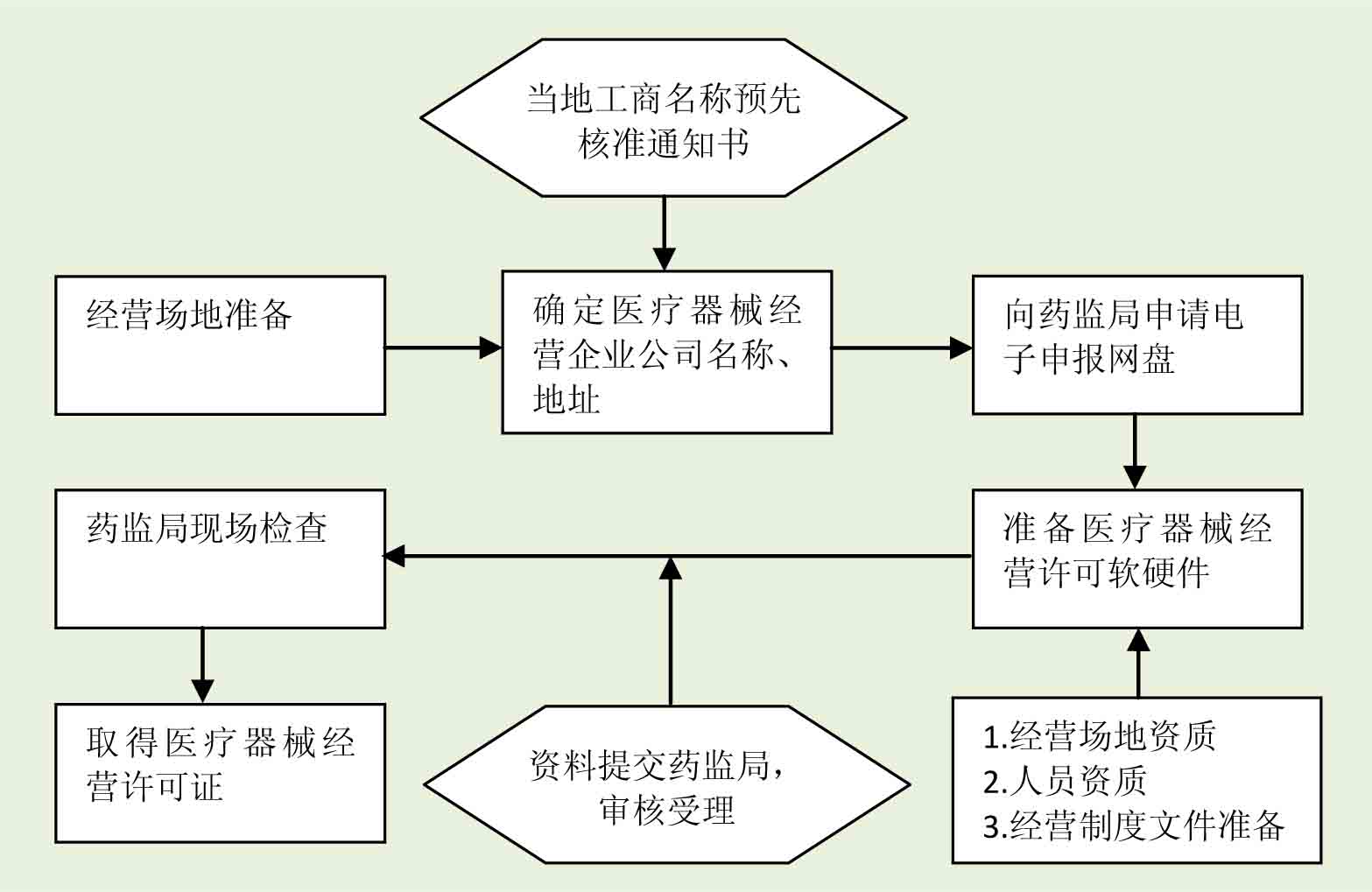
4. 服务内容
1.第Ⅱ类医疗器械经营企业备案服务。
2.第Ⅲ类医疗器械经营企业申办医疗器械经营许可证。
3.医疗经营企业场地的确认
4.医疗器械质量管理文件的相关咨询
5.医疗器械经营许可资料的审核及申报服务
更多
收起
-
服务流程资料添加中....
- 官方收费资料添加中....
- 基础法规资料添加中....
- 相关服务资料添加中....



















 全国服务热线:
全国服务热线:
